Lições da natureza
Economia energética dos organismos vivos
Qual é o combustível dos organismos vivos?
A luz solar é a fonte de energia primária em nosso mundo e os organismos fotossintéticos a usam para promover reações químicas de uma maneira controlada com um maquinário muito complexo que ainda está para ser completamente explicado. Estimulada pela absorção de luz, uma cascata de eventos físicos e químicos é responsável por produzir a "decomposição da água" em dioxigênio (O2) e átomos de hidrogênio (como NADH no interior das células) armazenando energia solar em ligações químicas. Como os produtos são termodinamicamente menos estáveis que água, em um ciclo biológico diferente, dioxigênio é reutilizado como um aceitador de elétrons, resultando em água como um subproduto e fechando a economia energética da célula.
As máquinas moleculares dos organismos vivos.
Fotossistema II
A oxidação de duas moléculas de água está acoplada a um fluxo de elétrons induzido pela absorção de fótons nos cloroplastos. A reação global é:
2H2O → 4H+ + 4e- + O2
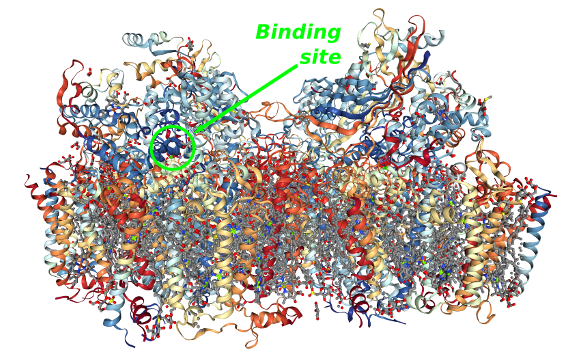
Todo esse processo acontece no Fotossistema II (PSII), um complexo proteico dimérico de membrana composto por 20 subunidades (figura acima) descrito em detalhes por Umena et al em 2011 .
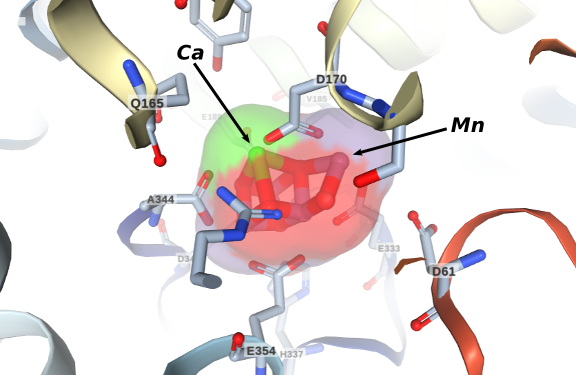 Quatro elétrons são extraídos de duas moléculas de água no sítio ativo conhecido como oxygen-evolving complex (OEC) mostrado na figura à esquerda. É composto de um cluster de cálcio e manganês normalmente representado pela fórmula Mn4CaO5. O entendimento sobre seu funcionamento ainda é um problema em estudo. Acredita-se que sua característica estrutural mais importante é sua configuração de cadeira distorcida, uma consequência da presença do íon cálcio. O mecanismo de ativação da água pelo OEC ainda é desconhecido e vários grupos de pesquisa importantes se dedicam a responder esta importante questão .
Quatro elétrons são extraídos de duas moléculas de água no sítio ativo conhecido como oxygen-evolving complex (OEC) mostrado na figura à esquerda. É composto de um cluster de cálcio e manganês normalmente representado pela fórmula Mn4CaO5. O entendimento sobre seu funcionamento ainda é um problema em estudo. Acredita-se que sua característica estrutural mais importante é sua configuração de cadeira distorcida, uma consequência da presença do íon cálcio. O mecanismo de ativação da água pelo OEC ainda é desconhecido e vários grupos de pesquisa importantes se dedicam a responder esta importante questão .
Citocromo C Oxidase
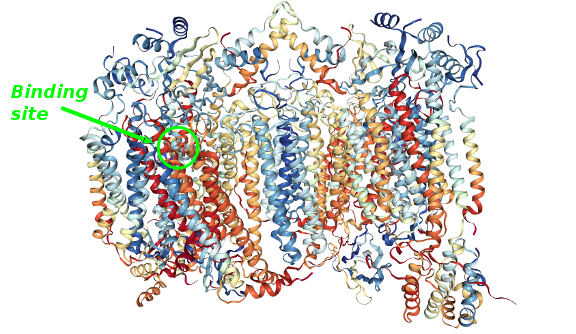
O estágio final da cadeia respiratória no interior das células acontece em um complexo enzimático conhecido como citocromo c oxidase ou Complexo IV. Uma cascata de reações redox termina nesse complexo em que quatro elétrons são transferidos para dioxigênio gerando água. A estrutura e função desse importante complexo enzimático foi descoberta por muitos cientistas ao longo dos anos, especialmente bioquímicos, inorgânicos e cristalógrafos.
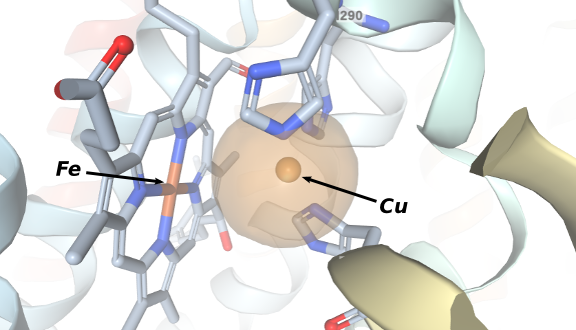 A estrutura cristalina da forma oxidada do citocromo c oxidase com suas 13 subunidades foi descrita em 1996 por Tsukihara et al . Este é o resting state da enzima e revelou com grande detalhe o sítio de reação onde o dioxigênio se coordena. A figura à direita mostra que um protoporfirinato de ferro(III) está posicionado frontalmente a um íon Cu(II) coordenado a três resíduos de histidina. Outras estruturas foram obtidas e vários modelos da enzima foram sintetizados nos anos 1990, especialmente pelo grupo do Prof. Collman da Stanford University .
A estrutura cristalina da forma oxidada do citocromo c oxidase com suas 13 subunidades foi descrita em 1996 por Tsukihara et al . Este é o resting state da enzima e revelou com grande detalhe o sítio de reação onde o dioxigênio se coordena. A figura à direita mostra que um protoporfirinato de ferro(III) está posicionado frontalmente a um íon Cu(II) coordenado a três resíduos de histidina. Outras estruturas foram obtidas e vários modelos da enzima foram sintetizados nos anos 1990, especialmente pelo grupo do Prof. Collman da Stanford University .
Todos esses resultados reunidos sugerem que o resting state precisa ser reduzido por dois elétrons para permitir a coordenação do dioxigênio e, quando isso acontece, uma ponte peroxo é formada entre Fe(III) e Cu(II). Os passos seguintes são transferências eletrônicas acopladas a transferências de prótons, transformando a ponte peroxo em duas moléculas de água, regenerando o resting state. A reação global é a redução tetraeletrônica do dioxigênio:
4H+ + 4e- + O2 → 2H2O